

《醫療器械注冊管理辦法》(國家食品藥品監督管理總局令第4號)第五條“境內第二類醫療器械由省、自治區、直轄市食品藥品監督管理部門審查,批準后發給醫療器械注冊證”、“境內第三類醫療器械由國家食品藥品監督管理總局審查,批準后發給醫療器械注冊證”;
服務項目:
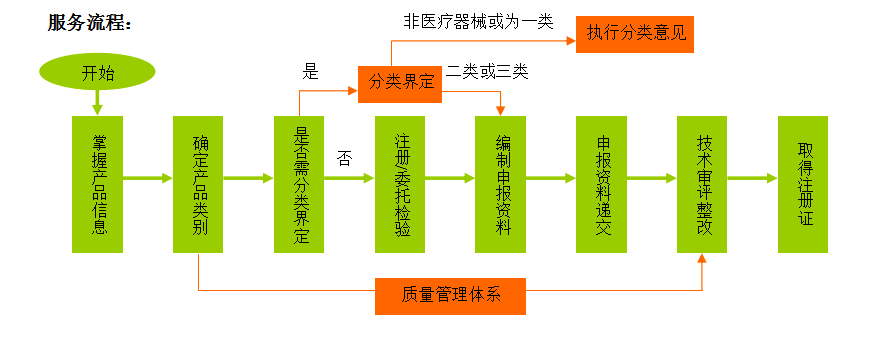
1)確定產品類別以及類代號;
2)必要時(僅適用產品不在現有分類目錄中),申請分類界定;
3)確定檢驗典型性型號、協助企業快速取得注冊檢驗報告或符合注冊要求的委托檢驗報告;
4)注冊質量管理體系核查;
5)臨床評價;
6)主導編制產品注冊所需的申報資料;
7)整理、審核申報資料,并指導企業遞交;
8)技術審評整改;
9)跟蹤、修訂(必要時)。
注意事項:
1、第二類醫療器械向申請人所在省、自治區、直轄市藥監局遞交注冊資料,第三類醫療器械向國家局藥監局遞交注冊資料(注:法規變動時,以最新法規為準);
2、質量管理體系貫穿整個取證階段,部分省市可能存在第二類產品首次注冊免予注冊核查的政策,具體視生產企業所在省級藥監部門法規決定;
3、注冊周期視產品種類、檢驗周期、是否具備臨床豁免條件以及注冊核查是否順利通過等條件限制,根據經驗,周期4~12個月不等(不含臨床試驗,部分產品甚至更長);
Copyright ? 2019 杭州醫咨佳科技有限公司. All rights reserved