

《醫療器械注冊管理辦法》(國家食品藥品監督管理總局令第4號)第五條“第一類醫療器械實行備案管理……境內第一類醫療器械備案,備案人向設區的市級食品藥品監督管理部門提交備案資料;進口第一類醫療器械備案,備案人向國家食品藥品監督管理總局提交備案資料”;
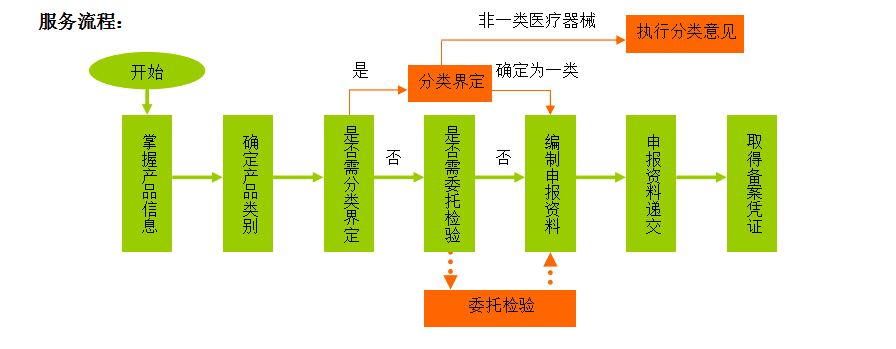
服務項目:
1)確定產品是否屬于第一類醫療器械;
2)必要時(僅適用產品不在現有第一類分類目錄中),申請分類界定;
3)主導編制產品備案所需的申報資料;
4)整理、審核申報資料,并指導企業遞交;
5)跟蹤、修訂(必要時)。
備注:
1、第一類醫療器械產品備案原則上向生產企業所在地設區的市級主管部門遞交備案資料,但不排除各地因政策差異導致受理主體或申報資料存在差異;進口第一類醫療器械備案,向國家局提交備案資料,香港、澳門、臺灣地區醫療器械的備案,參照進口醫療器械辦理;
2、按現有法規,第一類有源(帶電)醫療器械在產品備案前需取得EMC報告;針對企業無檢測能力的檢驗項目,也應取得委托檢驗報告;與人體直接接觸的器械還應按法規要求進行生物學評價;
3、常規情況下(無需分類以及檢驗的國產產品),產品備案總時長為2~4個工作日;
Copyright ? 2019 杭州醫咨佳科技有限公司. All rights reserved